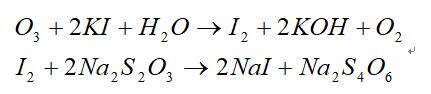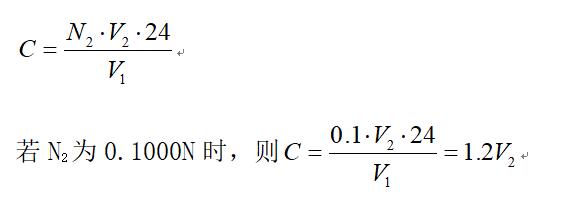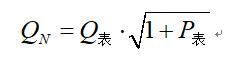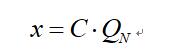臭氧对废水脱色处理能达到什么效果
来源:本站日期:2019/12/3 浏览:0
臭氧对废水脱色处理能达到什么效果
臭氧已广泛用于水处理行业,其作用也非常重要。本文介绍了臭氧脱色实验的目的,实验装置,实验步骤和实验步骤。
一,实验目的
1.了解臭氧的制备工艺和设备;
2.确定臭氧脱色对染色废水的影响。
3.研究水力停留时间(HRT)和臭氧剂量对漂白效果的影响。
4.了解臭氧发生器的工作原理以及如何测试水处理中使用的臭氧。
二、实验装置
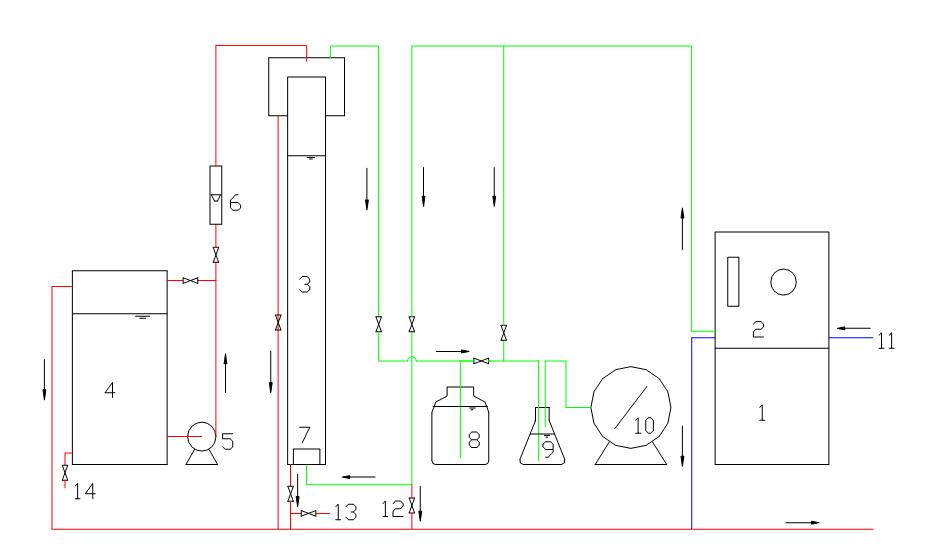
1、实验系统:包括臭氧发生器,制氧发生器、臭氧投配气水接触三部分。实验流程如图一所示。
1制氧机;2臭氧发生器;3反应柱;4原水箱;5水泵
6液体流量计;7钛板;8尾气吸收瓶;9测量瓶;10煤气表
11冷却水进口;12泄水阀;13出水取样口;14原水取样口
图一臭氧脱色实验流程图
2、流程说明:
i.制氧机:作为产生臭氧的气源。
ii.臭氧发生器:其原理及构造见教材。实验装置为单管(也可用多管或其他形式)发生器。
iii.接触反应柱:供臭氧与水接触反应用(气液逆向接触)。柱外境d=60毫米,内径d内=50毫米,柱高h=2米。布气板为微孔扩散板(材料为金属钛,孔径15~20微米),使气泡小而分散。
iv.水箱及水泵,提供实验水样。
3、仪器设备
i.在臭氧发生器上除有测定进气的流量计及压力表外,还有供臭氧发生器的电源控制用的变频变压器。
ii.为了控制臭氧的浓度和产量,设有测定臭氧浓度的吸收和滴定装置(即吸收瓶、煤气表和化学滴定仪器或臭氧浓度检测仪。
iii.在接触反应柱设有转子流量计,以及测定进气和尾气中臭氧浓度的装置,以了解臭氧的投加量和利用率。
iv.尾气用KI(或Na2S2O3)进行吸收,以防止污染。
三、实验水样
可用生产装置的原水样进行实验,也可用染料废水与自来水配制成一种或多种不同色度的水样进行实验。
四、实验步骤
1.熟悉装置流程、仪器设备和管路系统,并检查连接是否完好。
2.开启电源,开启制氧机开关,将制氧机出口气体流量为____L/min,此时出口压力为____ MPa。
3.通臭氧发生器的冷却用水。
4.水保护和气体保护警示灯熄灭后,开启臭氧发生器启动开关。
5.将变频变压器分别调到50V、75V、100V、125V、150V和175V,测定臭氧浓度,并绘出电压与臭氧浓度关系曲线。
6.将配好的水样用水泵打入水箱并进入反应柱内,打开反应柱的排水阀门,使柱内维持____ m水柱高度,控制流量在 ____ L/h,即停留时间为 ____ min。
7.调节变频变压器,稳定后使接触反应柱内脱色高度约为水柱高度的一半。此时变频变压器电压为____V,计算臭氧浓度为 ____mg/L,臭氧投加量为____ mgO3/L水,并测定进水和出水色度、进柱臭氧和柱顶尾气臭氧浓度。
8.维持气体流量和臭氧投加量不变,改变(增加和减少各一次)停留时间到 ____min,此时进水流量为____L/h,计算臭氧浓度为 ____mg/L,计算变频电压器电压为____V,观察脱色效果并并测定进水和出水色度、进柱臭氧和柱顶尾气臭氧浓度。
9.实验完毕后,首先停发生器的电源(先降压、再停电),然后停冷却水,最后再停气源,并关闭有关阀门。
五、实验报告要求
1.画出实验装置流程图,填好实验纪录表。
2.综合实验结果,整理实验纪录,对水处理效果从水深、接触时间、投加量、臭氧浓度进行综合评价,提出最佳设计参数。
3.提出实验改进意见、建议。
六、实验纪录参考格式
染色废水臭氧脱色实验纪录及汇总表 反应柱内径D=50mm
|
水样编号
|
|
|
染料品种或名称
|
|
|
柱内水深(m)
|
|
|
接触时间(min)
|
|
|
|
|
进水流量(L/h)
|
|
|
|
|
进气流量(L/h)
|
标准状态QN
|
|
|
流量计表示Q表
|
|
臭氧投加量(mg/L水)
|
计算投加
|
|
|
实际投加
|
|
|
|
|
脱色消耗
|
|
|
|
|
变频电压器电压(V)
|
|
|
|
臭氧浓度(mg/L)
|
计算浓度
|
|
|
|
|
实测浓度
|
|
|
|
|
尾气浓度
|
|
|
|
水质纪录(mg/L)
|
进水浓度
|
|
|
出水浓度
|
|
|
|
|
去除率(%)
|
|
|
|
|
臭氧利用率(%)
|
|
|
|
七、注意事项
做本实验,首先要注意安全,尤其高压电8000~20000V很危险。要防止臭氧污染。而且本实验使用的设备装置很多。因此必须做到:
1.实验前熟悉讲义内容和实验装置,不清楚时,不许乱动。
2.通电后,制氧机和臭氧发生器后盖不准打开。
3.尾气需用KI(或Na
2S
2O
3)进行吸收。若泄漏的臭氧浓度过高,要停机检查,防止对人体产生危害。
4.实验过程中各岗位的人不许离开,密切配合,并随时注意各处运行情况。若有某处发生问题,不要慌乱,首先停发生器的电源,然后再做其他处理。
附 录
一、臭氧浓度的测定和计算
-
方法原理:一般采用化学碘量法。利用臭氧与碘化钾的氧化还原反应,置换出与臭氧等当量的碘。再用硫代硫酸钠与碘作用,以淀粉为指示剂,待完全反应生成无色碘化钠。根据硫代硫酸钠的消耗量计算出臭氧浓度。其化学反应方程式如下:
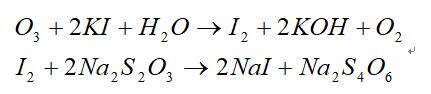
-
试剂:
-
20%碘化钾溶液:称200g碘化钾溶于800ml蒸馏水中。
-
6N的H2SO4溶液:以N1V1=N2V2公式计算配制。或取96%浓硫酸167ml,慢慢倒入833ml蒸馏水中。
-
0.1000N的Na2S2O3标准溶液:配制及标定方法见《水分析方法》教材145页。
-
1%淀粉指示剂:取1g淀粉溶解于100ml煮沸冷却的蒸馏水中,过滤后备用。
-
臭氧浓度测定步骤:
-
用量筒将20ml浓度为20%的碘化钾溶液加入到气体吸收瓶中,然后加入250ml蒸馏水摇匀。
-
从取样口通入臭氧化空气(控制转子流量计读数为500ml/min),用湿式煤气表计取气样2L,平行取两个样。
-
取样后,向气体吸收瓶中加5ml6N的H2SO4,摇匀后静置5min。
-
用0.1000N的Na2S2O3滴定,待溶液呈淡黄色时,加浓度为1%淀粉指示剂数滴使溶液呈兰褐色,继续使用0.1000N的Na2S2O3滴定至无色。记下Na2S2O3用量。
-
臭氧浓度计算:
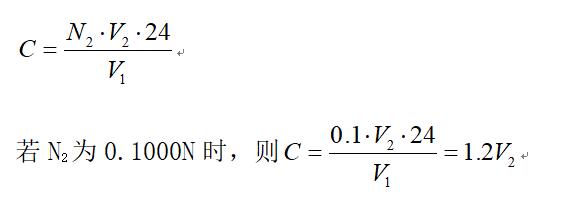
式中: N
2、V
2―Na
2S
2O
3的当量浓度(0.1000N)和滴定用量(ml)
V
1―臭氧取样体积(2L)
C―臭氧浓度(mg/L)
二、臭氧产量的计算
-
臭氧发生器(或反应塔)进气量计算:
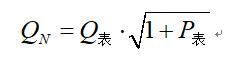
式中: Q
N―标准状态下的气体流量(Nm
3/h)
Q
表―压力状态下的气体流量(m
3/h)(即气体流量计的显示值)
P
表―压力表读数(大气压)
-
臭氧产量(或投加量)计算:
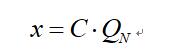
式中: C、Q
N同前
x―臭氧产量(或投加量)(g/h或mg/min)